港大研究揭示:金仓鼠实验证实新冠可通过气溶胶传播

疫情暴发以来,新冠病毒能否通过气溶胶传播一直是学术界的焦点之一。国际顶级期刊《自然》杂志最新刊发了香港大学团队的研究显示:在金仓鼠动物模型实验中,新冠病毒是可以通过气溶胶传播的。
该论文以“加快评审文章”(Accelerated Article Preview)形式在线发表,题为Pathogenesis and transmission of SARS-CoV-2 in golden hamsters。该论文的通讯作者为香港大学李嘉诚医学院严慧玲(Hui-Ling Yen),论文作者还包括香港大学公共卫生学院教授潘烈文。
新冠病毒出现之后,科研人员迫切需要合适的小动物模型来支持疫苗和治疗的研发。研究者报告了新冠病毒(SARS-CoV-2)在金仓鼠(金色叙利亚仓鼠)中的发病机理和传染性。免疫组织化学表明,金仓鼠接种病毒后2天和5天,其鼻粘膜、支气管上皮细胞和肺实变区域中存在病毒抗原。在接种病毒感染后7天,病毒迅速清除并有肺细胞增生。在金仓鼠十二指肠上皮细胞中也发现了病毒抗原,粪便中检测到病毒RNA。值得注意的是,动物模型试验证明:新冠病毒能通过直接接触以及气溶胶从被感染金仓鼠有效地传播到幼稚金仓鼠。仓鼠笼子中通过物媒传播的效率较低。尽管在接种仓鼠的鼻洗液中连续14天检测到病毒RNA,但新冠病毒可传播时间短。接种感染和自然感染的仓鼠表现出明显的体重减轻,所有金仓鼠康复后均能检测到中和抗体。这项结果表明,金仓鼠的新冠病毒感染特征类似于人类轻度感染的特征。
论文指出,合适的动物模型对于理解新冠肺炎的发病机理以及评估疫苗和治疗候选药物至关重要。先前对SARS-CoV进行的动物研究表明,病毒的刺突蛋白(S蛋白)与宿主的血管紧张素转化酶2(ACE2)受体之间的相互作用,以及被感染对象的年龄和先天免疫状态在发病机理中有着重要的作用。与SARS-CoV一样,SARS-CoV-2的S蛋白也利用ACE2受体(主要分布在肺和小肠的上皮细胞中)进入细胞进行病毒复制。SARS-CoV-2与人ACE2的结合良好,但与鼠ACE2的结合有限,这限制了近交系小鼠(inbred mice)在病毒研究中的应用。猕猴和表达人ACE2受体的转基因ICR小鼠被证明对SARS-CoV-2易感;但是,这些动物模型不那么容易获得。受到SARS-CoV-2攻击的食蟹猕猴和恒河猴分别表现出有限的和中等的临床症状。被感染的转基因小鼠表现出中等程度的肺炎,并且在非呼吸组织中没有明显的组织学改变。据报道,先前产生的表达人ACE2受体的转基因小鼠虽然支持支持SARS-CoV在呼吸道上皮细胞中复制,但由于转基因小鼠的脑中ACE2也是高表达,导致小鼠的死亡率还加入神经系统的病变的相关变量。
金仓鼠则是一种广泛使用的实验动物模型,此前研究表明,SARS-CoV能够在其体内复制,但MERS-CoV不能,这是由于MERS-CoV利用的是DPP4蛋白作为病毒进入细胞的主要受体,而非ACE2。先前,对5周龄的金仓鼠的SARS-CoV(Urbani毒株)的接种研究表明,病毒在其体内复制能力强,在接种病毒2天后的肺中就能检测到病毒滴度峰值;在接种病毒7天后,金仓鼠就能迅速清除病毒。不过接种病毒的金仓鼠并没有体重减轻或明显的疾病状况。一项后续研究报告说,在金仓鼠中测试了不同的SARS-CoV毒株,发现SARS-CoV毒株之间的毒力差异。据报道,用SARS-CoV(Frk-1菌株)对仓鼠具有致死性。Frk-1菌株与非致命性Urbani菌株的区别在于S2域中的L1148F突变。仓鼠也能被其他呼吸道病毒感染,包括人偏肺病毒、人副流感病毒和甲型流感病毒,并可能支持通过接触途径或空气传播流感。人、猕猴、小鼠和仓鼠的ACE2蛋白的比对表明,仓鼠ACE2可能比鼠类ACE2更能有效地与SARS-CoV-2的S蛋白相互作用。在这里,研究团队评估了SARS-CoV-2在4-5周大的雄性金仓鼠中的发病机理和接触传播能力。
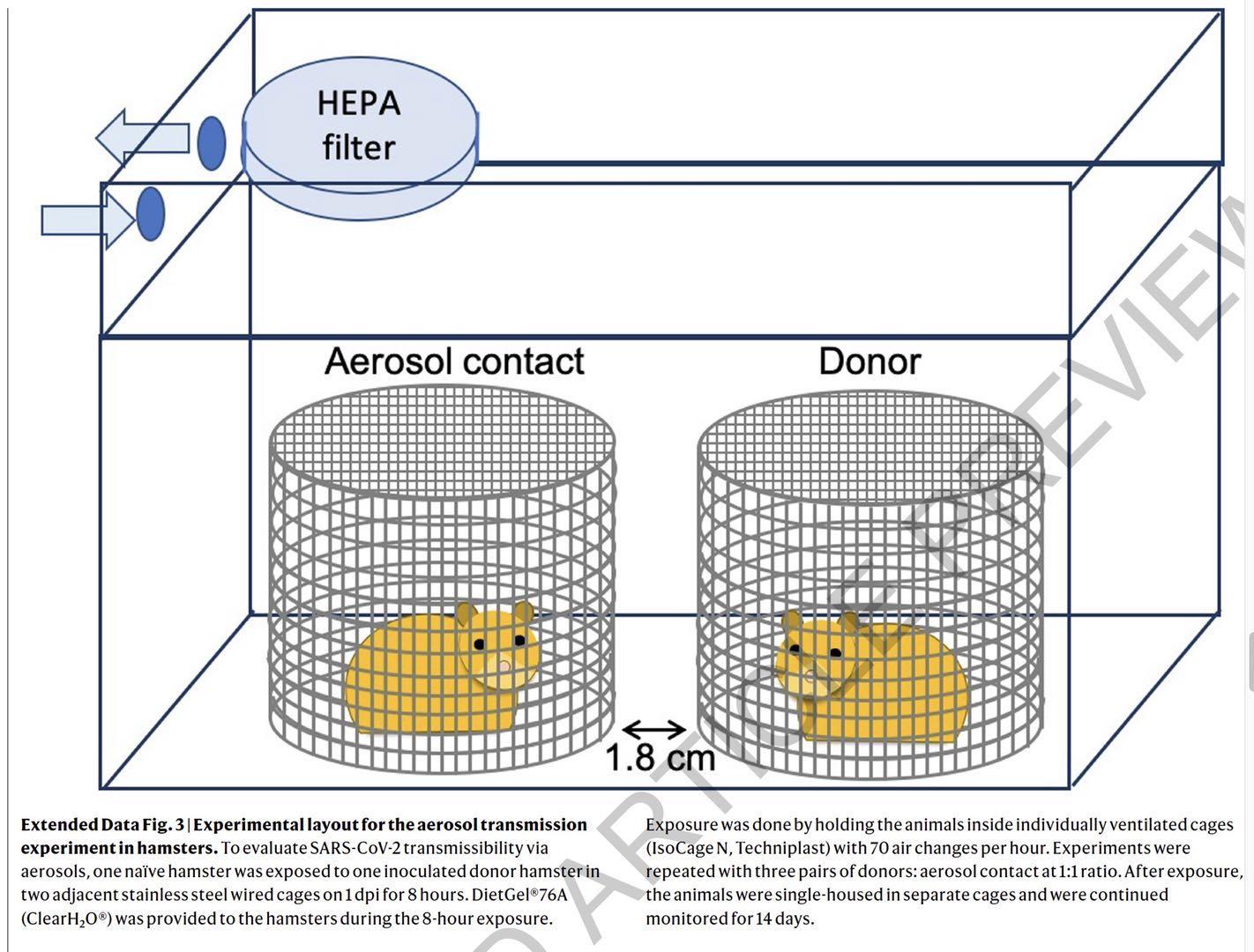
提示气溶胶传播动物模型实验
为了研究SARS-CoV-2在仓鼠中通过气溶胶的传播能力,研究者将供体(接受新冠病毒接种)仓鼠和幼稚仓鼠(健康仓鼠)分别放在两个相邻的铁笼中,在供体仓鼠接种病毒后1天,将两个笼子共同放置8小时,该实验如下:
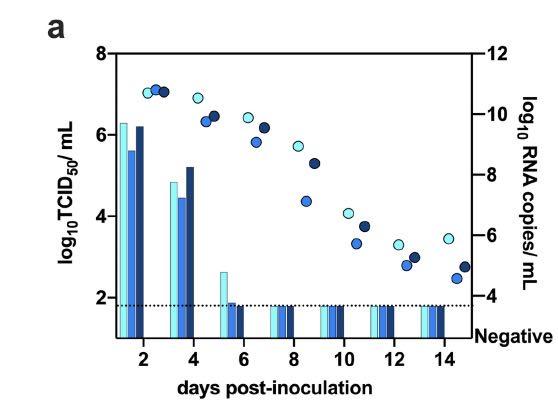
供体仓鼠洗鼻液中的传染性病毒能够排毒6天,而病毒的RNA则可连续检测14天,也就是说,在后期,被感染的仓鼠不具备传染能力。如下图所示:
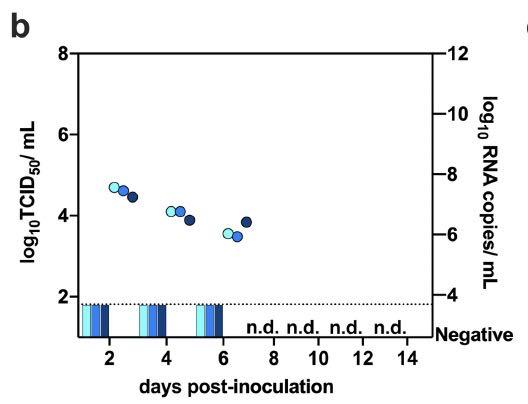
在接种病毒后2天、4天、6天的供体粪便样本中能检测到病毒RNA,但不是具备传染性的病毒,如下所示:
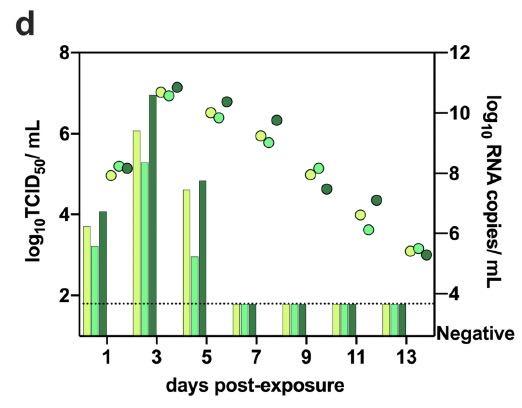
研究者发现,新冠病毒在仓鼠中的气溶胶传播是有效的,因为在接触后1天所有暴露的接触仓鼠鼻洗液中都检测到传染性病毒,在接触后3天病毒载量达到峰值,如下图所示:
尽管未分离出具有感染性的病毒,但从感染的气溶胶接触物的粪便样本中能连续14天检测到病毒RNA 14天,如下图所示:
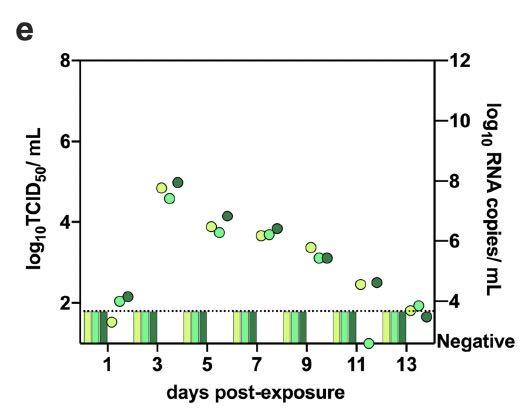
接触气溶胶的仓鼠在接触后7 天显示出最大的体重减轻(平均值±SD,-7.72±5,42%,N = 3)。与供体仓鼠相比,气溶胶接触仓鼠在鼻洗液中排出了相当数量的病毒。
SARS-CoV-2在金仓鼠中的发病机制
实验中,研究者给金仓鼠鼻内感染了8 x 10的负4次方TCID50(50%组织细胞感染量)的新冠病毒(Beta-CoV / Hong Kong / VM20001061 / 2020病毒,GISAID#EPI_ISL_412028)。该病毒是从香港一位新冠肺炎患者的鼻咽抽吸物和咽拭子的Vero E6细胞中分离出来的。研究者分别在金仓鼠接种病毒后的2天、5天、7 天时收集了鼻甲、脑、肺、心脏、十二指肠、肝脏、脾脏和肾脏组织,以监测病毒复制和组织病理学变化。在接种病毒后第2天时,能检测到金仓鼠肺部病毒载量峰值,在接种病毒后5天时病毒载量开始降低。尽管能继续检测到高拷贝的病毒RNA,但在接种病毒后7天未检测到具有传染性的病毒。
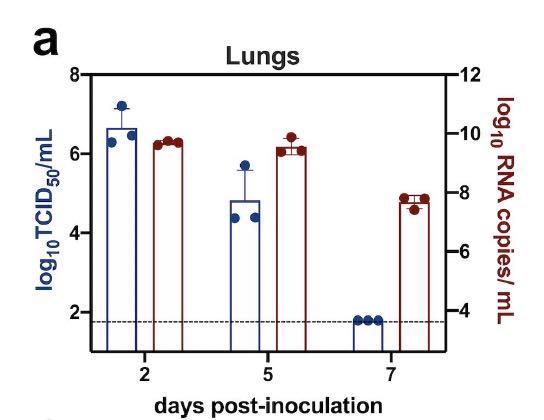
传染性病毒载量在接种病毒后的2天到7天之间有显著差异(P = 0.019,邓恩的多重比较测试),但RNA病毒拷贝数没有差异(P = 0.076)。尽管在接种病毒后的2天和5天时检测到低拷贝的病毒RNA,但在肾脏中未检测到具有传染性的病毒。
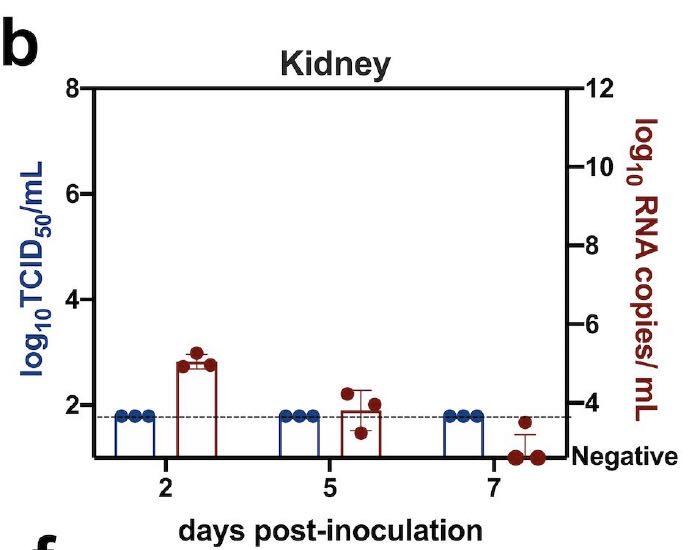
组织病理学检查发现,在接种病毒后2天,有5-10%的肺中炎性细胞增多和实变。
在接种病毒后5天,则有15-35%的肺中炎性细胞增多。
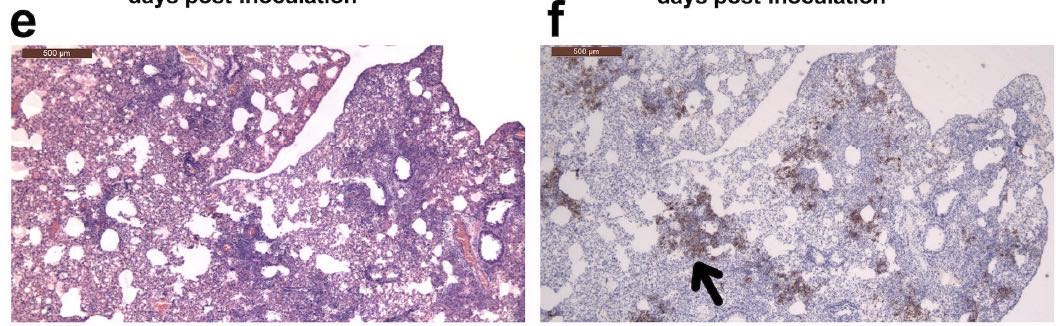
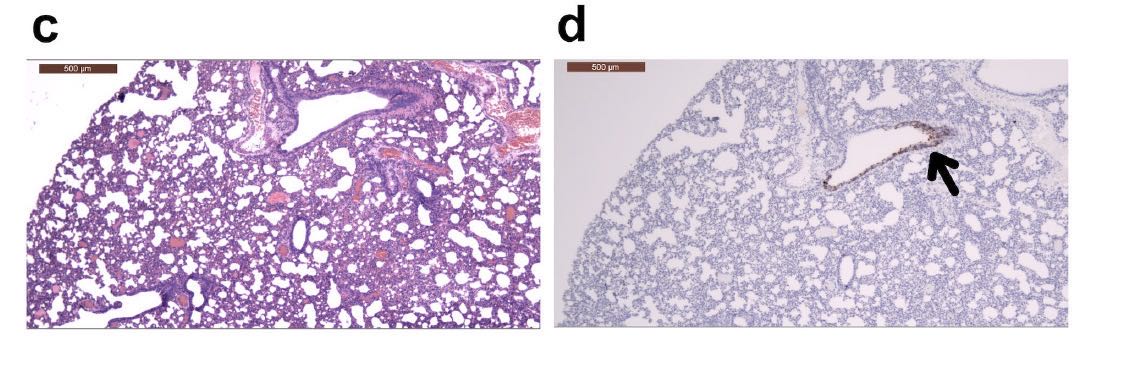
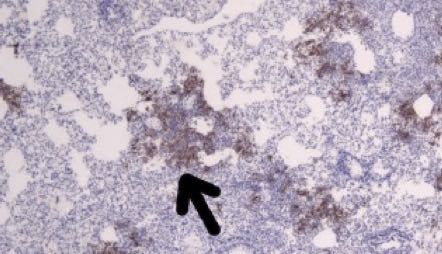
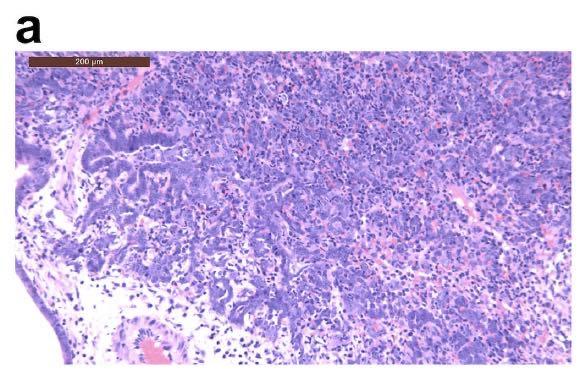
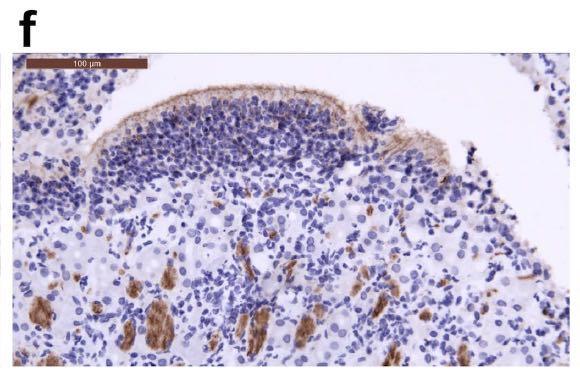
在接种病毒后2天和5天检测到病毒抗原的区域,可以观察到单核细胞浸润。SARS-CoV-2的N蛋白的免疫组织化学表明,在接种病毒后2天,金仓鼠的支气管上皮细胞中存在病毒抗原(下图的箭头所指位置)。
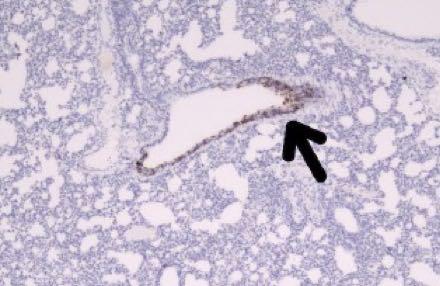
在接种病毒后5天,其发展为肺细胞(下图的箭头所指位置)。
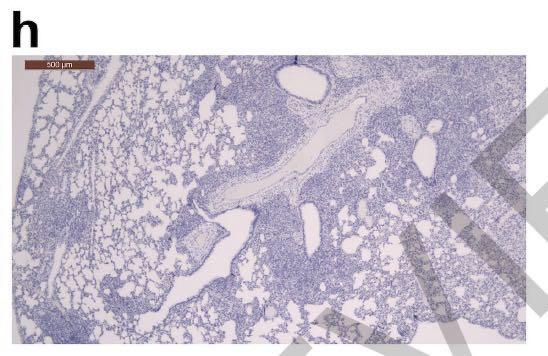
接种病毒后7天,30-60%的肺部实变,如下图所示:
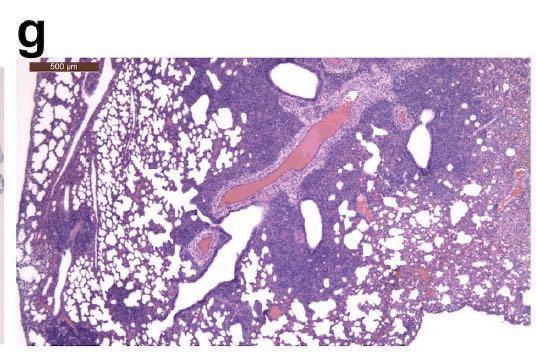
但是,没有检测到病毒抗原如下图所示:
而2型肺细胞增生则很明显,如下图所示:
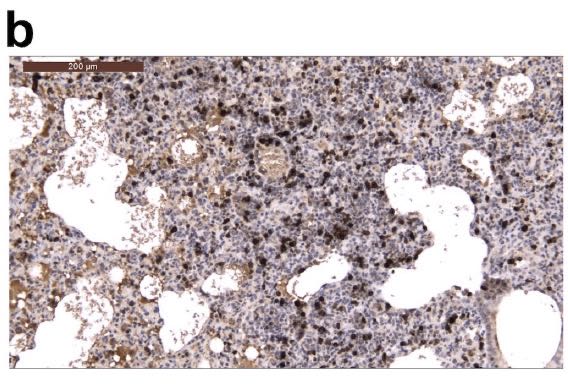
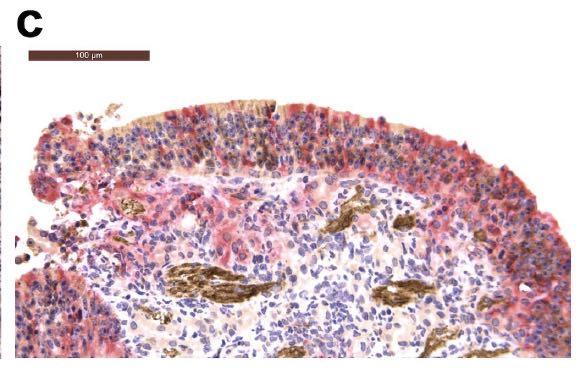
接种病毒后5天在支气管周围区域检测到CD3阳性T淋巴细胞,这可能有助于快速清除受感染的细胞,如下图所示:
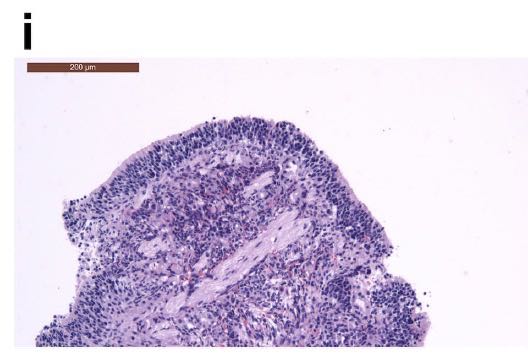
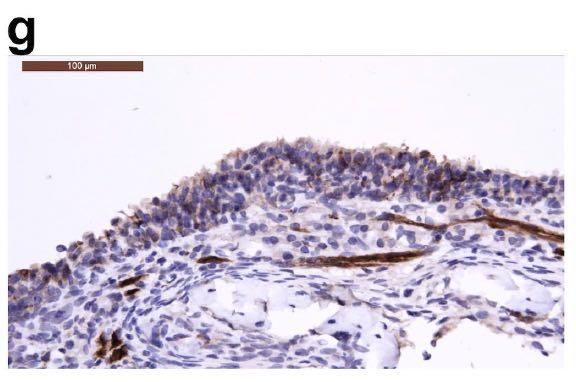
鼻甲中有炎性细胞浸润,如下图所示:
鼻上皮细胞和鼻粘膜的嗅觉感觉神经元中检测到病毒抗原,如下图所示:
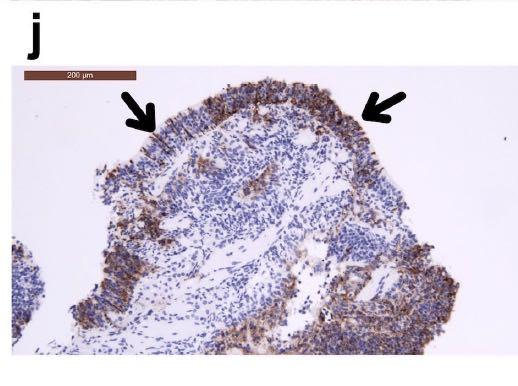
在表达SARS-CoV的N蛋白和神经元特异性β-III微管蛋白的细胞中进一步确认了嗅觉神经元中的感染,如下图所示:
与对照组相比,接种病毒感染后2天金仓鼠的鼻粘膜嗅觉神经元数量减少,如下图所示
接种病毒后7天,鼻上皮细胞衰减显著,如下图所示:
然后在接种病毒后14天可观察到组织修复,如下图所示:
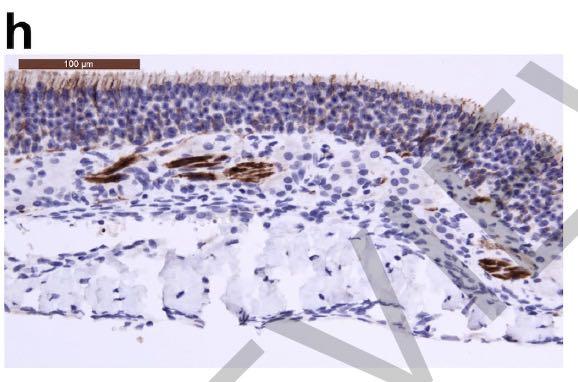
尽管十二指肠上皮细胞不存在炎症,如下图:
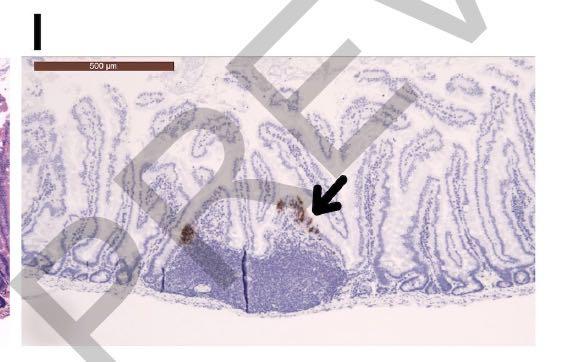
但在接种病毒后2天从十二指肠上皮细胞中检测到病毒抗原,如下图所示:
接种病毒后5天,从脑、心脏、肝脏和肾脏均未观察到明显的组织病理学变化,如下图所示:

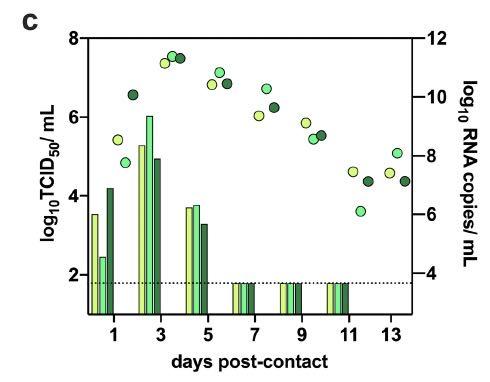
为了评估新冠病毒在仓鼠中的传播能力,研究者将3只供体仓鼠经鼻内接种8×10负4次方的TCID50病毒。接种后24小时,将每个供体转移到新的笼子中,并与一只幼年仓鼠一起饲养。研究者每天监测体重变化和临床体征,每隔一天从供体仓鼠和接触仓鼠收集鼻洗液,持续14天。在供体仓鼠中,尽管连续14天都能检测到病毒RNA,但感染性病毒的峰值出现在接种病毒后早期,随后迅速下降,如下图所示:
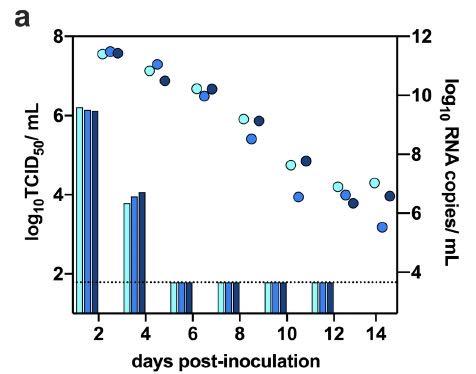
接种SARS-CoV-2后6天,仓鼠表现出最大的平均体重减轻(平均值±SD,-11.97±4.51%,N = 6),如下图所示:
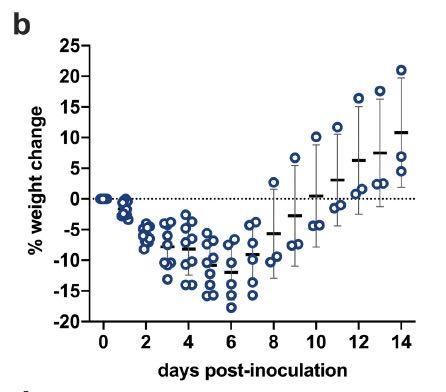
从供体到接触者的传播非常高效,在接触后1天,就能从共居仓鼠中检测到SARS-CoV-2,在接触后3天的共居仓鼠鼻洗液中检测到了病毒载量峰值,如下图所示:
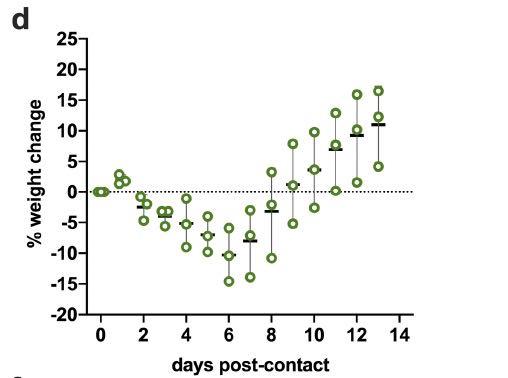
共居仓鼠在接触后6天出现最大的平均体重减轻(平均值±SD,-10.68±3.42%,N = 3),接触后11天,所有动物均恢复原始体重,如下图所示:
使用PRNT分析,从接种病毒后14天的供体上(所有滴度为1:640)和共居仓鼠接触后13天(以1:160、1:320和1:160滴度)检测中和抗体。研究者连续14天从供体仓鼠的鼻洗液中检测到病毒RNA,但传染性病毒滴度迅速下降。研究者重复了该实验,并以接种病毒后6天供体仓鼠与幼稚仓鼠共居。在接触后3天,共居幼稚仓鼠鼻洗液中能够检测到少量病毒RNA,在接触后7天的鼻洗液中检测到不到病毒RNA。而且,在鼻洗液中未检测到传染性病毒,如下图所示:
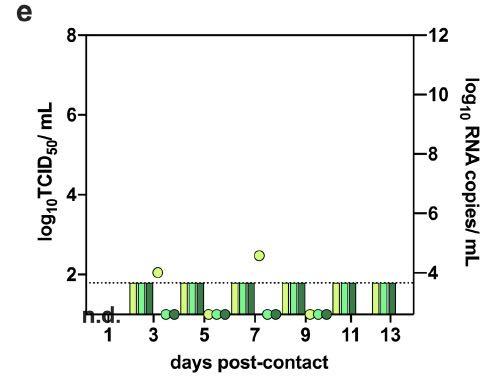
并且共居仓鼠没有显示出体重减轻,如下图所示:

PRNT分析未检测到接触后12天的共居仓鼠的中和抗体(<1:10)。结果表明,接种SARS-CoV-2的供体的病毒可传播时间短于6天。从供体到共居接触者的后续传播与在供体鼻洗液中检测到感染性病有关,而与能否检测到病毒RNA无关。
从供体到共居接触者的病毒传播可以通过多种传播途径来介导。



















 鲁公网安备37020202370232号
鲁公网安备37020202370232号